一、引言
随着《(EU) 2017/746 体外诊断医疗器械法规》(IVDR)的全面实施,临床可用性已成为制造商证明产品安全性、有效性及可实现性能的重要证据基础。临床可用性不仅再局限于界面友好,如直观易懂,操作便捷等方面,而是与风险管理、性能评价及上市后监督形成合规闭环。
二、IVDR中临床可用性的法规来源
IVDR并未单设“临床可用性”章节,其要求分布在多个关键条款:
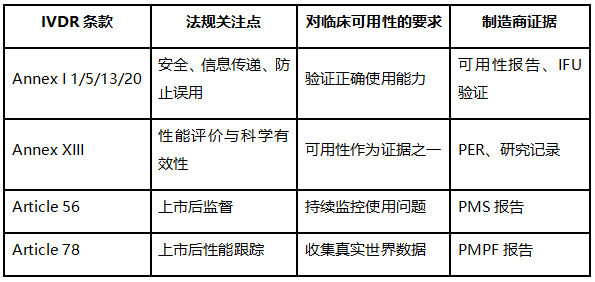
Annex I:通用安全与性能要求(GSPR)
Annex XIII:性能评价与临床证据
Article 56:上市后监督(PMS)
Article 78:上市后性能跟踪(PMPF)
Annex II / III:技术文档与PMS文档结构要求
核心要求可概括为:制造商须证明产品在真实使用环境下可被预期用户安全、可靠、有效地使用。
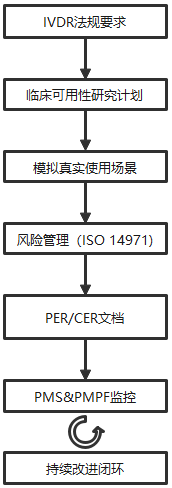
三、制造商临床可用性研究的五大关注点
1. 明确预期用途、预期用户与使用环境
制造商必须在研究启动前明确产品的预期用途、操作人员特征及临床环境。
研究对象应覆盖实际临床中的代表性用户类型,如检验人员、临床医生、护理人员或非专业用户。研究设计应考虑班次工作、噪音环境、时间压力及多任务操作等真实场景。
2. 可用性研究必须嵌入风险管理体系
IVDR要求可用性活动与ISO 14971风险管理协同开展。
应识别高风险操作步骤、潜在误用及信息传达缺陷,并将结果反馈到风险分析中。
研究结果应作为风险控制有效性的客观证据,而非仅停留于满意度评价。
3. 研究设计应模拟真实临床流程
研究场景应尽可能贴近实际操作流程,包括异常处理、重复操作、批量测试等情况。
验证在边界条件下用户是否仍能正确操作,特别关注结果误判和延误处理的风险。
4. 数据应具备可追溯性与文件化
应建立从研究方案、原始记录到结论的完整证据链。
研究结果需与风险管理文件、说明书、培训材料保持一致,确保审计时可追溯。
5. 临床可用性是持续活动
制造商应将可用性纳入PMS与PMPF体系,持续追踪用户反馈及使用错误。
当产品升级或使用场景变化时,应重新评估可用性风险。
四、IVDR条款对照表
五、IVDR法规下的临床可用性合规模型
六、结论
在IVDR体系下,临床可用性已成为性能评价与风险控制的关键证据。制造商应将其视为持续改进的重要工具,而非一次性注册活动。




